治験は、製薬企業主導でしか行えませんでしたが、2003年の法改正により、医師主導でも行うことが可能になりました。
しかしながら、日本における治験実施体制が、新しい医薬品臨床試験実施基準に対応するレベルになっておらず、治験の実施数が減ってしまいました。
また、体制の整っている欧米で先行して治験を行う企業が増えて来ています。このことから、日本の治験は先進諸外国と比較して「遅れている」と言われてきました。
そこで、今、日本では、国をあげてこの治験の空洞化に対処しようとしています。 *1)
治験は、開始前、実施中、及び終了後のタイミングでそれぞれ必要な工程がいくつもあります。
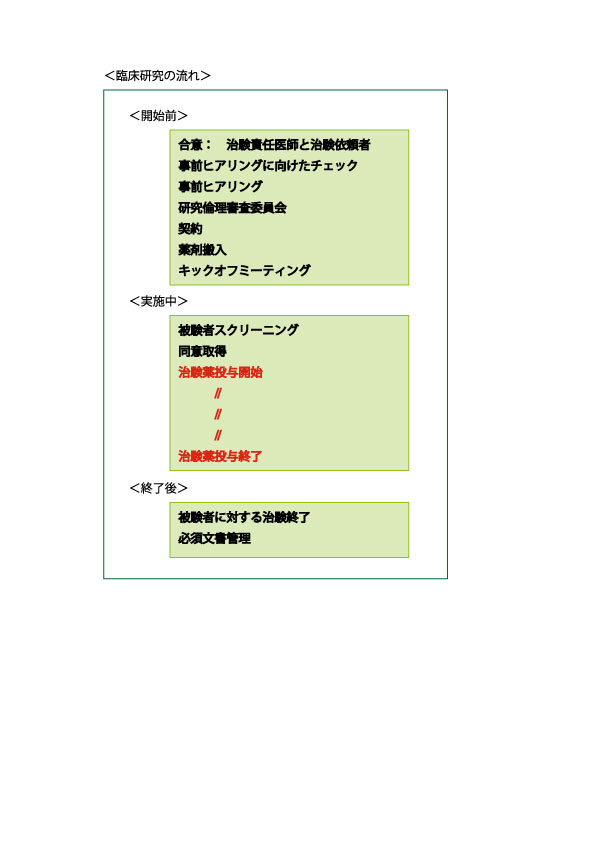
実施中の新薬投与開始から終了までの間において、検体の管理がとても重要です。
治験における検体検査は、院内体制が整っている場合でも、治験という目的の性格上、測定機器や試薬等の違いによる測定結果のぶれを防ぐため外部の検査機関に送付する場合が多いです。
院内であっても、外部の検査機関であっても、検体検査を実施する機関では治験台帳として採血日、被験者名、治験名、測定期間、採血時間等必要条項を記録するとともに輸送時の環境、採血から遠心までの時間等、定められた検体処理手順の遵守が必須です。
この「検体処理手順」の遵守が正しく行われたことの証跡を、信頼できる方法で記録するためには、システムの利用が必要不可欠なのです。
比較的大きいといわれる検査機関でさえ、紙のマニュアルを使用し、人間がラベルに書き込み、インキュベータの温度管理を信頼し、使用する試薬を目視で選んでいるところが多いのが現状ではないでしょうか?
いくらプロフェッショナルとはいえ、人間であれば間違いは起こりえます。
システムを導入しアラート検知する仕組みがない状況において、手順や判断の誤りに気が付かず、無意識のうちに間違いが起こっているのです。
私たちの未来を救うための新薬をつくるための治験において、意識されないこのひとつのほころびが、不完全な新薬へとつながります。
弊社は、治験の空洞化の解消に貢献すべく、システム導入を通じて検査機関における検体管理を強化し、ミスの無い安心・安全を提供します。
*1)
臨床研究・治験活性化5か年計画 2012 アクションプラン(文部科学省・厚生労働省)
http://www.mhlw.go.jp/topics/bukyoku/isei/chiken/dl/121025_3.pdf


