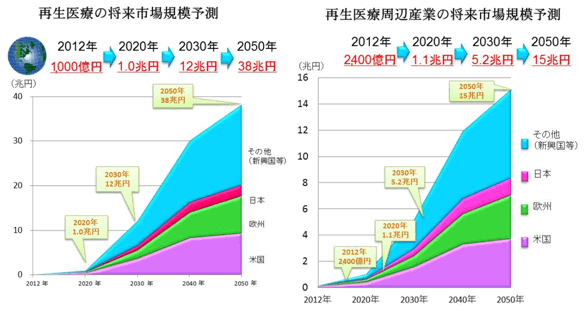
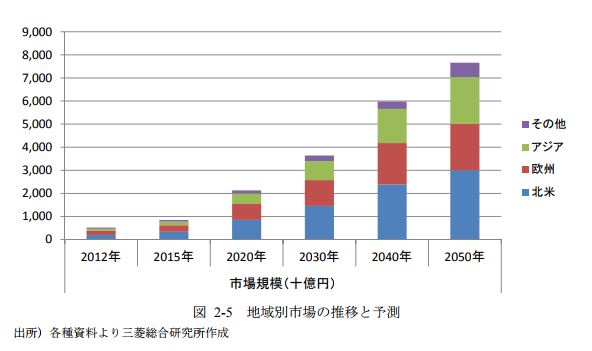
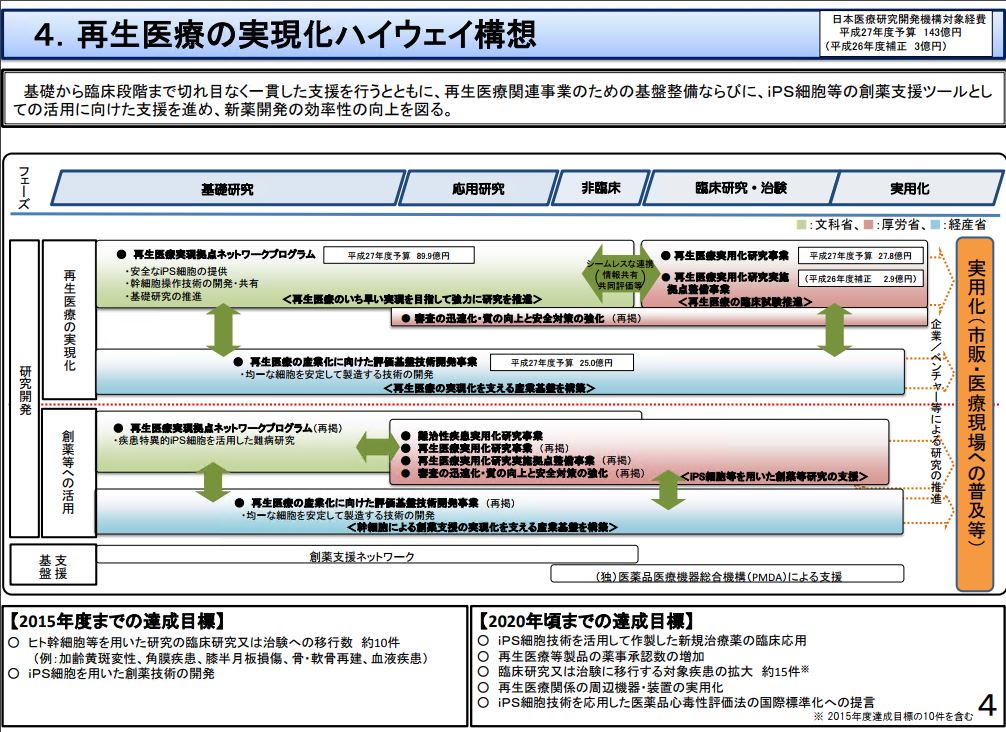
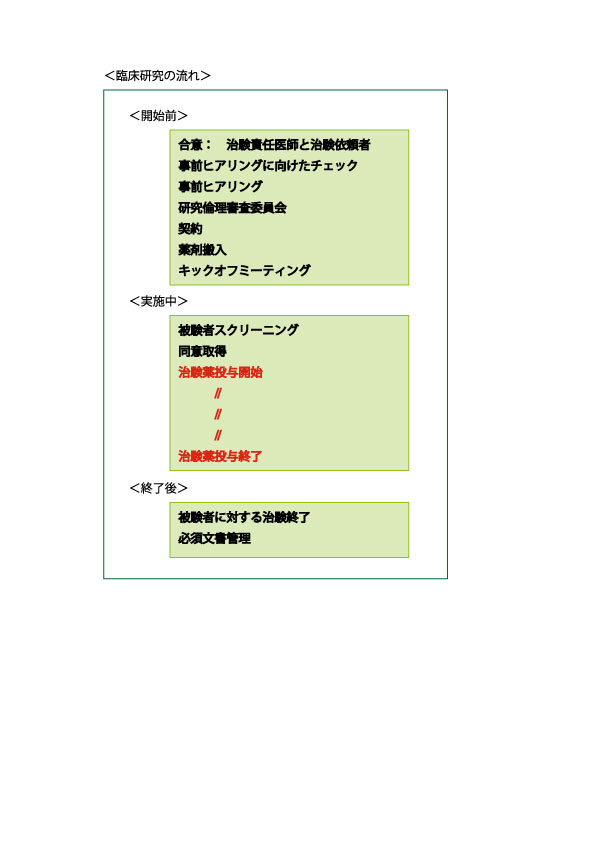
2017年8月30日、Kymriah(キムリア)が米国食品医薬品局(FDA)から正式承認されました。
個別医療(ゲノム創薬)の新時代の到来です。
Kymriah(キムリア)は、ノバルティスファーマ株式会社の海外における製品名でCTL019と呼ばれる患者さん自身のT細胞の単回投与により行うがん治療法です。
難治性または2回以上の再発を認めるB細胞性急性リンパ芽球性白血病(ALL)の25歳以下の患者さんを対象とする初めてのキメラ抗原受容体T細胞(CAR-T)医療です。
米国食品医薬品局(FDA)は、このKymriah(キムリア)の静脈注入用懸濁液を承認したことを発表しました。
FDAが初めて承認する遺伝子導入に基づく治療法だとプレスリリースされました。
米国では、「初の遺伝子療法」と呼ばれているようです。
キメラ抗原受容体T細胞(CAR-T)とは、キメラ抗原受容体(CAR)を用いた遺伝子改変T細胞療法です。
実際の進め方は、まず患者から血液を採取し、そのT細胞に遺伝子改変を加え(=CARの実装)、その遺伝子改変T細胞を患者の体内に戻すというものです。
Kymriah(キムリア)の価格は47万5,000ドル、約5,335万円と非常に高額ですが、アナリストの予想を下回ったとのことです。
がん免疫薬「オブジーボ」は当初1ヵ月300万円(1年で3,600万円)でした。これを継続的に投与しなければなりません。
一度の投与で治療される、Kymriah(キムリア)のこの価格を、皆様はどの様に考えるでしょうか?
キメラ抗原受容体T細胞(CAR-T)の開発には、すでに多くの企業が参入しており、日本においても、第一三共が今年1月に「Kite社とのがん領域細胞治療薬パイプラインに関する包括提携」をプレスリリースしています。
ちなみに、この包括提携の元で開発するKTE-C19は、CD19と呼ばれる悪性リンパ腫細胞の表面に発現している抗原を標的とする細胞治療薬(キメラ抗原受容体T細胞:CAR-T)で、静脈内投与により再発性または難治性の悪性リンパ腫に対する治療効果が期待されています。
悪性腫瘍細胞を攻撃する代表的なものとしては、NK(ナチュラルキラー)細胞、Tリンパ球(細胞障害性T細胞)、樹状細胞等があります。
蛇足ながら、昨今、一部の人々による臍帯血の問題等が世間を騒がせていますが、それによってすべての免疫療法が間違いという風潮にはあまり賛成できません。
患者から血液を採取し、培養または改変し、それを患者に再び戻すという治療がたくさんの人々を治癒へと導く時代がくることを信じたいものです。
当社が提供するトータルソリューションシステム「Carly」を導入し、正しい手順の踏襲と問題発見後の原因分析にご活用頂きたいです。
見える化・分かる化を実現します。